Átomos são entidades compostas por três ‘tipos’ de partículas: prótons, nêutrons e elétrons, que estão divididas em duas ‘seções’ diferentes: núcleo e eletrosfera.
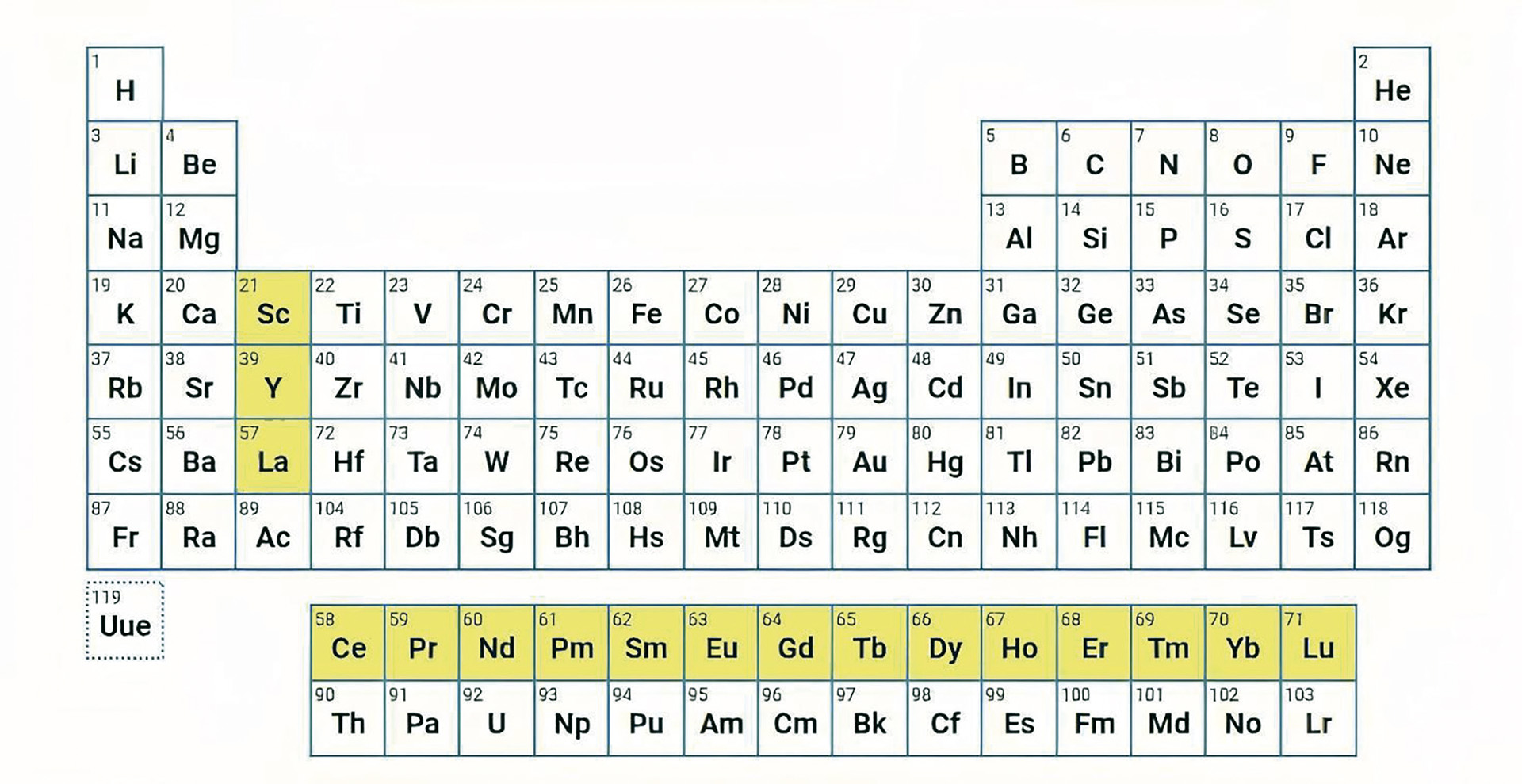
O núcleo é composto por prótons, que têm carga elétrica positiva, e nêutrons, sem carga. A quantidade de prótons no núcleo de um átomo é o seu ‘número atômico’. Cada elemento tem um número atômico correspondente, e é ele que define a forma na qual os elementos são organizados na Tabela Periódica.
A distribuição dos elétrons (carga negativa) define o comportamento químico de um elemento.
A mecânica quântica – teoria que lida com os fenômenos nas dimensões atômicas e subatômicas – nos mostra que existem níveis energéticos específicos que podem ser ocupados pelos elétrons. Cada um desses níveis está dividido em ‘subníveis’.
Atualmente, sabemos que todos os elementos químicos distribuem seus elétrons por quatro tipos diferentes de subníveis eletrônicos, chamados s, p, d e f – com a ordem de energia aumentando do s ao f.
Entre os 17 terras-raras, 14 têm, em suas configurações eletrônicas, elétrons alocados no subnível f. Por causa disso, a química desses elementos é bem peculiar. As particularidades do subnível f fazem com que o raio desses átomos – definido como a distância média do núcleo do átomo até o elétron mais externo – varie muito pouco entre eles.
A consequência disso é que os elementos que vão do lantânio até o lutécio se comportam quimicamente de forma similar. Essa similaridade química é responsável pelo fato de sempre encontrarmos esses 14 elementos juntos em minerais na natureza e de ser difícil separá-los uns dos outros.
Os 107 anos que separam a descoberta, em 1901, do európio – o último dos elementos das terras-raras isolado a partir de minerais – daquela do ítrio, em 1794, por Gadolin, são reflexo da similaridade química entre eles. Desde o fim do século 18, não raramente, anúncios de ‘novas’ terras-raras se mostraram, na verdade, misturas desses elementos.
Apenas em 1913, quando o físico Henry Moseley (1887-1915) determinou que o número atômico era o que determinava a identidade de um elemento, os equívocos sobre a descoberta de ‘novas’ terras-raras tiveram fim.
Só em 1940 um método robusto de separação desses elementos foi desenvolvido, no contexto do projeto Manhattan – que desenvolveu as duas bombas atômicas lançadas sobre o Japão em agosto de 1945 – pelo químico canadense-estadunidense Frank Harold Spedding (1902-1984).
Ainda hoje, novos métodos de separação desses elementos, para obtê-los em purezas cada vez maiores, são tema de intensa pesquisa científica. O grande interesse tecnológico e econômico explica-se porque a pureza desses elementos determina sua performance em aplicações especializadas.
Ironicamente, a mesma distribuição eletrônica que torna extremamente desafiadora a separação desses elementos também confere a eles as propriedades físico-químicas que os tornam ‘grande objeto de desejo’ para aplicações de alta tecnologia: suas propriedades ópticas e magnéticas são praticamente impossíveis de reproduzir com o uso de outros elementos ou outras combinações de elementos.