
Tratar o indivíduo antes de a doença se manifestar. Esse é o princípio da medicina individualizada ou personalizada que, para tal, coloca a pessoa no centro do acompanhamento de saúde. Sim, é uma oposição à medicina tradicional, na qual é a doença que dirige as tomadas de decisão no atendimento médico, na conduta da equipe e nos sistemas de saúde.
Nas práticas médicas tradicionais, olha-se para as médias. São os achados e as intercorrências prevalentes em grandes conjuntos de pacientes que guiam diagnósticos e práticas. A nova medicina se preocupa com a variação e a especificidade das ocorrências no contexto em que o indivíduo está inserido. A ideia é canalizar esforços para cada pessoa antes que ela se torne um paciente, o que levará à redução de impactos negativos em sua vida e à consequente diminuição dos custos em saúde.
Em outras palavras, a medicina personalizada coloca em prática o ditado “prevenir é melhor que remediar”, já difundido e consolidado em saúde coletiva, área em que imunização, vigilância sanitária e epidemiológica são protagonistas. Com o uso de tecnologias como a genômica (área que estuda o material genético dos indivíduos) e a ciência de dados, essa nova medicina também chamada “P4” (Preventiva, Preditiva, Personalizada e Participativa) promete melhorar o acompanhamento de cada indivíduo por meio de métodos analíticos de risco, considerando um imenso conjunto de dados. Todos esses dados dão suporte à tomada de decisão precoce para conduzir a prevenção, predizer desfechos e possibilitar um tratamento pontual à pessoa afetada.
Em teoria, todos poderiam ou deveriam se beneficiar dessa nova medicina. Entretanto, há desafios intrínsecos decorrentes da própria biologia, demografia e do viés da história recente, em especial em contextos como o da sociedade brasileira. O motivo? A maior parte dos estudos em genômica populacional envolvem indivíduos de ancestralidade europeia, o que impacta diretamente nas possibilidades de desfrutarmos desses avanços no Brasil.

Até 1500, data reconhecida da chegada dos europeus para o início da exploração da então chamada Terra de Vera Cruz, os povos originários nativo-americanos e africanos de diferentes etnias, que forçadamente atravessaram o Atlântico – escravizados pelos europeus –, tinham se mantido “separados” geneticamente por milhares de anos. Esses povos, com informações genéticas particulares de cada população, passaram então a compartilhar não apenas nossas paisagens – grande parte da população brasileira passou a mesclar pedaços dos genomas dessas populações ancestrais.
Para que as características individuais permitam a prevenção, predição e a acurácia de diagnósticos, precisamos conhecer o genoma dos diferentes grupos populacionais que constituem nossa sociedade, já que a história da espécie humana envolve dinâmicas de migração e isolamento nos territórios continentais, e isso se reflete em seus genomas.
Hoje, a maior parte dos bancos de dados internacionais praticamente não contêm dados de nativo-americanos e africanos, uma vez que são, em grande parte, alimentados a partir de dados de pesquisa conduzidas nos Estados Unidos e Europa, e também de testes pagos de ancestralidade, disponíveis principalmente para pessoas de origem europeia, em decorrência das desigualdades históricas.
A pesquisa em genômica populacional de brasileiros começou há algumas décadas, mas apenas recentemente, com a redução de custos de análises amplas acerca da variação genética, foram viabilizados estudos de maior porte e de sequenciamento do genoma completo. Isso passa a nos permitir conhecer as variações genéticas comuns, compartilhadas por várias pessoas, e raras, exclusivas do indivíduo ou da família.
Há pouco mais de dez anos, o Centro de Pesquisas sobre o Genoma Humano e Células-Tronco (CEGH-CEL), do Instituto de Biociências da Universidade de São Paulo (USP), iniciou um projeto de pesquisa para construção de um banco de dados genômico de brasileiros idosos, com o objetivo de montar uma referência de controles para estudos genômicos considerando as ancestralidades presentes em nossa população.
E por que idosos? Em sua maioria, essas pessoas já passaram da idade de manifestação de boa parte das doenças genéticas raras e, também, já podem apresentar comorbidades comuns da vida adulta, como diabetes, hipertensão e dores articulares. Ao observar se esses idosos desenvolveram ou não essas doenças, podemos entender melhor a propensão genética da nossa população para desenvolvê-las.
O CEGH-CEL contou com a colaboração do Estudo SABE (Saúde, Bem-estar e Envelhecimento) da Faculdade de Saúde Pública, também da USP, que acompanha idosos sorteados do censo do município de São Paulo desde o ano 2000. A amostra é riquíssima, dado que os idosos recebem em suas residências uma equipe multidisciplinar que aplica questionários de saúde, hábitos de vida e atividades diárias, mapeando inclusive a casa e a rede de apoio de cada participante.
Por ser uma amostra censitária, o Estudo SABE já contribuiu com o avanço do conhecimento acadêmico sobre o envelhecimento e também com políticas públicas voltadas para idosos, grupo que mais cresce na demografia brasileira e já acrescenta enormes desafios à sociedade. Desde 2010, os participantes do SABE se voluntariaram na formação do banco de dados genômicos, até o momento o maior de uma amostra representativa de uma população brasileira.
Nesse estudo foram incluídos 1.171 genomas completos de pessoas não aparentadas, um número modesto em relação a projetos internacionais, como o Biobanco do Reino Unido (UK Biobank), que conta com mais de 450 mil participantes. Ainda assim, o primeiro resultado da análise da amostra sequenciada de brasileiros permitiu melhor compreensão de padrões de miscigenação populacional e sua relação com a autodeclaração racial já identificados em estudos anteriores com menores amostras. Apesar da proporção de trechos genômicos europeus diminuir em indivíduos autodeclarados pardos e pretos, 90% das declarações apontam indivíduos miscigenados em maior ou menor grau, à exceção dos japoneses, que nesta geração são ainda pouco miscigenados.
A partir dessa amostra compreendeu-se o tamanho da lacuna de conhecimento quando são analisados indivíduos não-europeus: dois milhões de variantes genéticas detectadas na amostra de São Paulo estavam ausentes, ou seja, nunca antes vistas em ninguém.
O problema evidenciado, é que, ao sequenciar pacientes brasileiros para fins de diagnóstico molecular ou aplicações em medicina personalizada, um número significativo de variantes do nosso genoma não seria detectado em bancos públicos majoritariamente compostos com dados de pessoas de ancestralidade europeia, levando a potenciais erros de interpretação.
A essa altura, você pode estar se perguntando: como conhecer a miscigenação brasileira pode contribuir para políticas em saúde pública?
Há doenças genéticas recessivas que apresentam incidências diferentes em cada população. Por exemplo: enquanto a anemia falciforme (e outras doenças da família das hemoglobinopatias) é mais prevalente em populações africanas, a fibrose cística ocorre mais entre povos europeus. Ao buscar portadores de mutações associadas a essas doenças, ou seja, indivíduos saudáveis que carregam uma variante patogênica (e para manifestar uma doença recessiva, são necessárias duas dessas variantes, também chamadas alelos), é possível predizer, com precisão, qual é o risco dos casais virem a ter uma criança afetada.
O estudo dos idosos brasileiros do SABE estimou a incidência dessas doenças a partir de portadores e sugeriu que a nossa população apresenta ocorrências equivalentes nas populações ancestrais. Assim, políticas públicas em saúde podem ter mais pistas sobre como reduzir o número de famílias afetadas e planejar orçamentos condizentes com os prováveis desfechos. Esse dado, junto aos de outras doenças recessivas ainda mais raras, contribui para entendermos o impacto nos sistemas de saúde sobre o risco da ocorrência em nossa população.
As pesquisas também evidenciam a diversidade em outros aspectos da arquitetura genômica, como a ocorrência de milhares de elementos móveis ainda não descritos na literatura. Esses elementos são pequenos trechos de DNA que se deslocaram de uma parte do genoma e se inseriram em outra, o que pode resultar em efeitos como interrupção de um gene ou alteração de sua expressão. Este tipo de variante genética é pouco estudado, pois requer a análise de genomas completos, além de ser pouco conhecido em populações miscigenadas.
O estudo verificou ainda grande diversidade nos genes da família HLA, que codificam as proteínas de superfície que atuam no reconhecimento de patógenos e de células do próprio corpo. Há muitas variantes em HLA na espécie humana, e isso é reflexo direto da adaptação a infecções. Tal diversidade também é responsável pela dificuldade de encontrar doadores de órgãos compatíveis em casos de transplante. Conhecer as variantes em HLA ajuda na compreensão sobre aspectos genéticos da imunologia de infecções, doenças autoimunes e em transplantes de órgãos.
Por fim, ao sequenciar genomas completos, nem todos os pedaços do DNA são encontrados no genoma de referência, que funciona como uma espécie de “mapa” para detectar as variações de maneira comparativa. Isso acontece porque a referência foi obtida a partir de um conjunto pequeno e homogêneo de pessoas. Na amostra brasileira, segmentos genômicos totalizando mais de 60 milhões de bases (as letrinhas que compõem o genoma) estavam ausentes nesse genoma de referência – mais um indicativo do quanto há para se entender sobre o genoma a partir de populações pouco estudadas. Os dados desse estudo estão disponíveis para consulta de forma gratuita no Arquivo Brasileiro Online de Mutações.
Esses resultados nos levam a concluir que, assim como os brasileiros estão fora do mapa da genômica internacional, as populações parentais (nativo-americanas e africanas) também não são incluídas. Se atentarmos para comunidades isoladas, como grupos rurais, ribeirinhos, quilombolas e indígenas ou mesmo nas periferias das grandes cidades, a proporção de ancestralidades não representadas nos bancos de dados é ainda maior do que nos centros urbanos.
Falar sobre ancestralidade do ponto de vista genético no Brasil implica reconhecer e considerar a escravização e desumanização dos corpos negros e indígenas que, até hoje, vivenciam o legado das violências e desigualdades iniciadas com a colonização. Estes fatos que eram, até poucas décadas, descritos por evidências históricas e sociais foram reforçados em estudos genômicos. Em especial, os estudos sobre DNA mitocondrial (herdado pela linhagem materna para filhos homens e mulheres) e do cromossomo Y (herdado do pai para filhos homens) confirmaram uma contribuição assimétrica de homens europeus e mulheres indígenas e negras na consolidação da sociedade brasileira hoje, fruto de exploração e violências já conhecidas.
Se do ponto de vista biológico uma divisão da nossa espécie em “raças” seja fruto de arbitrariedades e vícios classificatórios – já que, mesmo com todas as diferenças e especificidades de cada população ancestral, a proporção de semelhanças e de variação genética compartilhada é significativamente maior –, pelo enfoque social, as assimetrias entre as populações de ascendência indígena, africana e europeia são inegáveis.
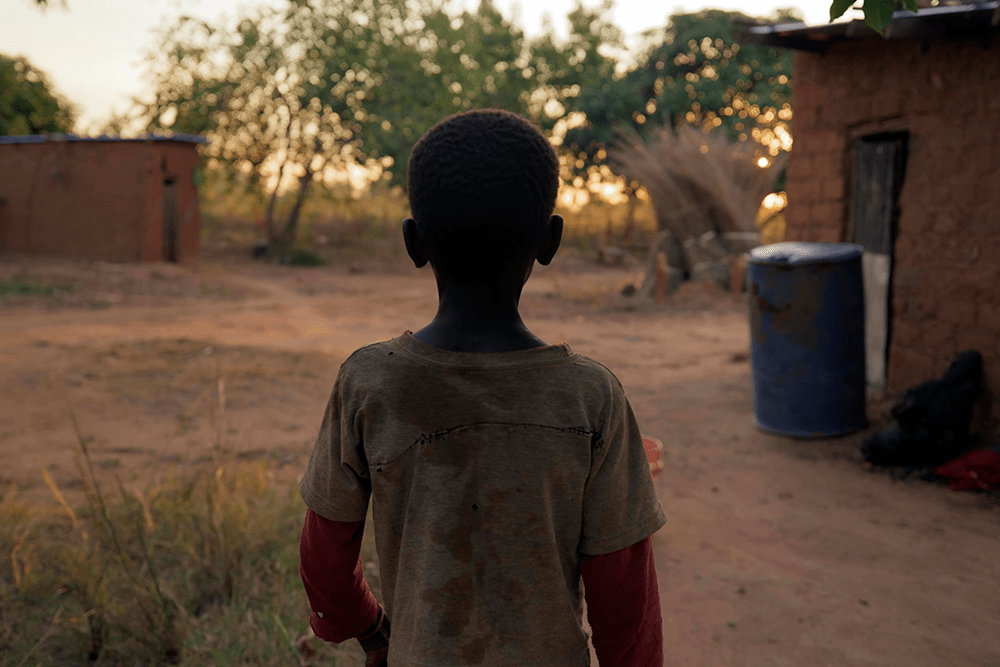
As diferenças socioeconômicas resultam, entre outras coisas, em desigualdades na qualidade de vida, o que inclui condições de moradia, trabalho, alimentação e lazer, afetando a saúde em seu sentido mais amplo. De maneira geral, as populações não-brancas – negras, indígenas e periféricas – têm menor expectativa de vida, menos acesso a cuidados médicos, tratamentos, hospitais e cuidado humanizado. Em estudo recente no município de São Paulo, foi mensurada uma diferença de expectativa de mais de 20 anos entre alguns bairros periféricos e aqueles com maior poder aquisitivo.
Se por um lado ainda enfrentamos esses problemas básicos, por outro, mundialmente se torna cada vez mais viável a introdução da medicina individualizada e de precisão.
Para que o potencial dessa nova medicina seja aproveitado no Brasil, não apenas considerando seu desempenho mas também justiça social aplicada à saúde, o avanço deve ser inclusivo. Sem a participação e representação de grupos diversos, tanto para composição dos bancos de dados quanto na condução dos estudos e em papéis de tomada de decisão, corremos o risco de avançarmos tecnologicamente sem acolher grande parcela da população.
Mas o que fazer para evitar que as assimetrias já existentes em saúde persistam ou se ampliem?
A resposta exige considerar nosso Sistema Único de Saúde (SUS) como via de implementação em larga escala desses avanços que envolvem genômica e medicina. A partir do entendimento da importância desse investimento para saúde e, portanto, para a economia, grandes consórcios de pesquisa em epidemiologia genômica foram implementados, por exemplo, no Reino Unido. Por lá, a iniciativa do UK BioBank é conduzida em unidades de saúde do sistema nacional de saúde (NHS) com protocolos robustos de acompanhamento, consentimento e proteção de dados individuais sensíveis. O programa já tem fornecido dados de qualidade que possibilitaram avanços acerca da complexa arquitetura genética de condições de saúde de grande impacto como doença arterial coronariana, diabetes, obesidade e câncer de mama e ovário. Evidentemente, o alto custo do projeto exigiu um modelo de governança único e a integração de fontes públicas e privadas de financiamento, que também precisa ser pensado para o contexto brasileiro.
A oportunidade de conduzir um projeto desse porte em um país como o Brasil é única, já que temos não apenas um repertório rico de ancestralidades diversas como também graus variados de miscigenação. Nossa arquitetura genética particular impossibilita a importação dos modelos de risco a doenças a partir dos dados derivados de europeus e norte-americanos, ou seja, precisaremos construir as nossas próprias bases de dados.
Aprofundar o conhecimento sobre nossa população possibilitará descobertas sobre mecanismos que causam doenças, dando-nos pistas sobre intervenções e medicamentos possíveis. Dessa maneira, o Brasil estaria em uma situação ideal não apenas para a aplicação direta dos avanços médicos, como também contribuiria com conhecimento que beneficiaria o mundo todo.
Iniciativas promissoras já existem: o BIPMed (Brazilian Initiative on Precision Medicine) e o projeto DNA do Brasil, que se propõem, respectivamente, a integrar dados genômicos gerados por outros estudos e sequenciar grupos de voluntários já acompanhados no país. O Programa Genomas Brasil, lançado em 2020 pelo Ministério da Saúde, prevê o sequenciamento de 100 mil brasileiros, mas ainda não tornou públicas quais estratégias de amostragem, de coleta e como assegurar orçamento para execução e manutenção dos projetos. Há urgência em constituirmos bases de dados genômicos e acompanhamento de saúde em brasileiros, o que exige estudos coordenados com amostras representativas em todas as regiões do país, tanto nas grandes cidades quanto de grupos isolados e financiamentos constantes.
Os testes genéticos para triagem de portadores e diagnóstico molecular já atingiram custos viáveis, especialmente se comparados aos valores de tratamento ou o longo caminho de um diagnóstico desafiador por exames tradicionais. Se por um lado a genética é democrática e as mutações que levam a doenças atingem aleatoriamente qualquer pessoa, os meios de utilização dessas informações genéticas pela medicina personalizada ainda será restritivo se não houver investimento no acompanhamento continuado e na análise genômica de 100 mil brasileiros ou mais. Do contrário, é inevitável que as assimetrias em saúde sejam mantidas ou mesmo ampliadas.

Viver em um país com desigualdades sociais graves traz desafios para praticamente todos os setores da sociedade. A multietnicidade nesse Brasil ainda distante da democracia racial exige atenção para a promoção da equidade quando pensamos na garantia de direitos básicos como o acesso à saúde. A diversidade que nos caracteriza pode nos tornar pioneiros no desenvolvimento da medicina personalizada e em sua aplicação, para que, no futuro, possamos contar com sistemas de saúde que sejam de fato universais, inclusivos e justos.
Mariana Inglez e Michel Naslavsky
Departamento de Genética e Biologia Evolutiva
Universidade de São Paulo

Imagine um país com dezenas de milhões de habitantes, com sérios problemas no sistema educacional, uma alta desigualdade social e uma paixão quase insana pelo futebol. Foi lá, na Turquia, que brotou uma extraordinária experiência de aprendizagem conhecida como a Vila Matemática, fruto do trabalho do matemático Ali Nesin, o entrevistado da CH deste mês.

Da Bahia à Antártica, pesquisadores usam abordagem baseada na genética para desvendar mais sobre os microrganismos presentes no ambiente e suas funções. Alerta de spoiler: embora possam ser danosos, esses seres microscópicos atuam muitas vezes como guardiões do nosso planeta e de seus habitantes.

A Década do Oceano tem como um de seus desafios compreender os impactos dos diversos fatores de estresse nos ecossistemas marinhos e promover a sua conservação. As mudanças climáticas, evidentemente, estão entre as graves ameaças à saúde dos mares.

Análises espaciais e temporais dos padrões de desmatamento na bacia hidrográfica apontam para uma cobertura majoritária de pastagem e agricultura no período de 1985 a 2019. A partir dessas ‘trajetórias evolutivas’, é possível saber ‘quando’, ‘quanto’, ‘onde’ e ‘o que’ se perdeu de floresta.

Crença infundada de que mulheres têm menos habilidades do que homens em algumas áreas, como matemática e orientação espacial, pode levar à falta de representatividade do gênero no ambiente dos jogos digitais e até prejudicar o desempenho das jogadoras.
Doença causada pelo parasita Toxoplasma gondii atinge milhões de brasileiros, com consequências graves para a saúde pública. Pesquisadores estão propondo alternativas de tratamento para acelerar o processo de descoberta de novos medicamentos e assim beneficiar os pacientes.

A exploração do espaço voltou a ganhar momento, com a entrada em cena não só de novas agências espaciais, mas também de empresas que exploram comercialmente essa atividade. A tensão ideológica que marcou esse campo foi substituída pela cooperação

O mercado de sementes modificadas e dependentes de pesticidas tóxicos à saúde e ao ambiente está cada vez mais concentrado em algumas poucas megaempresas. É essencial visibilizar as formas de produção por trás do que comemos para alcançar alternativas saudáveis e justas

Há 50 anos, o lançamento do satélite Landsat-1 transformou nosso olhar sobre a superfície terrestre. Hoje, as técnicas de machine learning e deep learning promovem uma nova revolução, desta vez na “visão” dos computadores e no sensoriamento remoto do planeta

Nas matas brasileiras, a biodiversidade é exuberante. Plantas gigantescas e animais imponentes. Mas os mistérios podem se esconder nos detalhes. Esse é o caso de um sapinho ‘surdo’ e ‘brilhante’, cuja anatomia miniaturizada segue intrigando os biólogos

Comunidades indígenas pré-coloniais já praticavam formas de urbanismo. Hoje, as mídias sociais são aliados na busca por uma representação mais justa dessas populações, que, com frequência e de forma errônea, são consideradas desconectadas de suas tradições, culturas e terras.

Alunos buscam tema sobre sustentabilidade para uma feira de ciências da escola. Um especialista sugere o seguinte: células solares, que geram energia elétrica a partir da luz – e não poluem o meio ambiente. Hoje, essa tecnologia está amplamente presente em nosso cotidiano

O chamado ‘problema da medição’ na mecânica quântica tem ajudado especialistas a responder a perguntas profundas, quase filosóficas, como: ‘os resultados experimentais são realmente objetivos?’ e ‘há uma fronteira real entre os mundos macro e microscópico?’

O arsênio ganhou fama por ser o veneno usado pela nobreza para matar inimigos, parentes ou amantes. Mas há uma face realmente nobre – e pouco revelada – desse elemento químico: é um fármaco usado ao longo da história para tratar várias doenças
| Cookie | Duração | Descrição |
|---|---|---|
| cookielawinfo-checkbox-analytics | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookie is used to store the user consent for the cookies in the category "Analytics". |
| cookielawinfo-checkbox-functional | 11 months | The cookie is set by GDPR cookie consent to record the user consent for the cookies in the category "Functional". |
| cookielawinfo-checkbox-necessary | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookies is used to store the user consent for the cookies in the category "Necessary". |
| cookielawinfo-checkbox-others | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookie is used to store the user consent for the cookies in the category "Other. |
| cookielawinfo-checkbox-performance | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookie is used to store the user consent for the cookies in the category "Performance". |
| viewed_cookie_policy | 11 months | The cookie is set by the GDPR Cookie Consent plugin and is used to store whether or not user has consented to the use of cookies. It does not store any personal data. |
