
O consumo mundial de carne hoje é quatro vezes maior do que há 50 anos. O aumento não se deve apenas ao crescimento da população do planeta, mas também ao avanço econômico nos países de renda média, como China e Brasil. A produção de carne já ultrapassa as 330 toneladas por ano, segundo dados da Organização das Nações Unidas para a Alimentação e Agricultura (FAO).
Mais gente comendo mais carne. Isso é uma boa notícia? Não para o meio ambiente, a saúde humana e o bem-estar animal. Dentre os danos atribuídos à indústria da carne, destacam-se o desmatamento, a formação de zonas mortas no oceano, a poluição do ar e da água e a emissão de gases de efeito estufa. Resistência aos antibióticos, epidemias de doenças zoonóticas, bem como o risco de transmissão de doenças devido à contaminação fecal do alimento durante o abate e processamento da carne também são sérias ameaças à saúde pública atribuídas, em parte, a essa atividade econômica.
Esses danos podem ser ainda maiores nas próximas décadas, pois a população global estará entre 9 e 10 bilhões em 2050. Para alimentar toda essa gente mantendo os níveis de consumo atuais, as estimativas são de que a produção mundial de carne deverá dobrar, um crescimento que os especialistas consideram insustentável para o planeta.
A preocupação com todos esses impactos tem impulsionado a busca por outras formas de se produzir esse alimento tão presente nas mesas do mundo todo. É nesse contexto que surge a proposta de cultivar carne em laboratório, uma alternativa mais limpa, sustentável e que reduz o abate indiscriminado de animais. Carne in vitro, carne à base de células (cell based meat) e carne limpa (clean meat) são algumas das denominações usadas para o produto. Pesquisas de opinião ainda estão em curso para avaliar o nome que será mais aceito pelo consumidor.
A ideia de produzir carne em laboratório não é nova. Há quase 90 anos, o político e estadista britânico Winston Churchill (1874-1965) previu que, no futuro, existiria uma tecnologia capaz de produzir partes de animais em laboratório para nos alimentar, sem a necessidade de sacrificar seres vivos. Na época, não havia tecnologia para tal. Foi somente no início dos anos 2000 que a primeira patente na área foi depositada pelo pesquisador holandês Willem Van Eelen (1923-2015), um entusiasta da causa. Na mesma época, um projeto financiado pela Nasa, a agência espacial norte-americana, produziu carne de peixe a partir do cultivo in vitro de partes do músculo esquelético de peixes dourados.
Em 2013, o farmacologista holandês Mark Post (1957-) provou que era possível aplicar as técnicas de cultura celular e produzir um hambúrguer de carne cultivada em laboratório. Esse hambúrguer custou US$ 250 mil e foi apresentado ao mundo em um programa na rede de TV britânica BBC.
Seja qual for o nome mais saboroso, a carne é produzida em laboratório por meio do cultivo de células animais a partir da combinação de técnicas de biologia celular e bioengenharia. É um produto idêntico, em nível celular, à carne convencional. Empresas e grupos de pesquisa ainda estão em estágio de desenvolvimento do produto e de melhoria dos processos; por isso, avaliam diferentes formas de produção. Apesar de os métodos não terem sido revelados em detalhes, provavelmente seguem algumas variantes de dois processos: a cultura em suspensão e a cultura tridimensional.
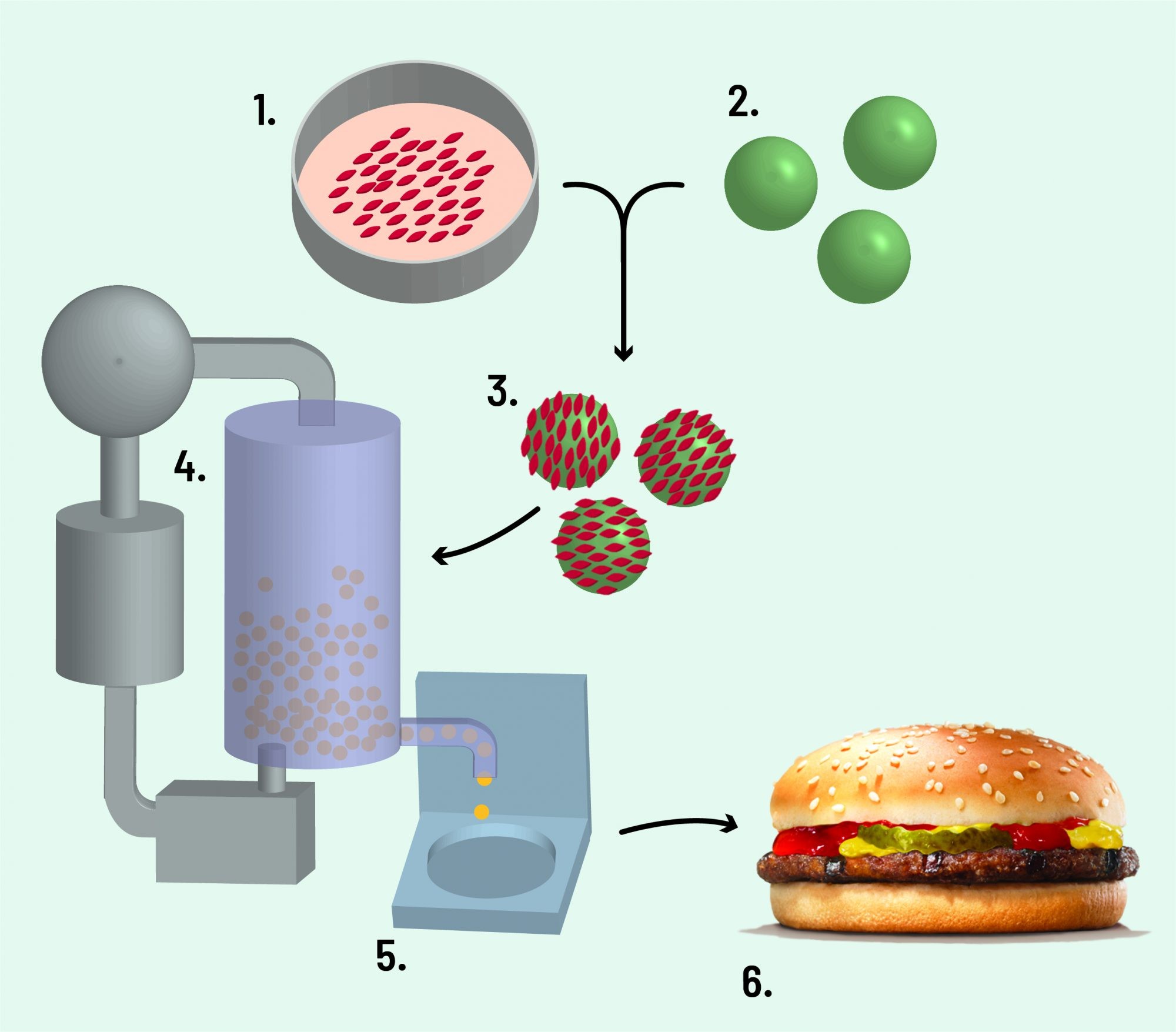
Mais simples e eficiente, o método de cultivo em suspensão tem sido o mais explorado. Começa com uma biópsia para a retirada de um pedaço muito pequeno, em geral do tamanho de uma semente de gergelim, do tecido muscular esquelético do animal. Esse tecido contém uma série de células, mas as mais utilizadas no processo são satélites, células-tronco adultas que proliferam a uma taxa aceitável e podem se diferenciar apenas em células musculares esqueléticas.
Essas células satélites são isoladas e levadas a um tanque de agitação, o biorreator, contendo o meio de cultura, rico em nutrientes, sais e fatores de crescimento. Dentro do biorreator, são simuladas as condições fisiológicas presentes no corpo do animal. É um ambiente dinâmico, que permite trocas gasosas e de nutrientes, além de manter a temperatura controlada.
As células satélites só crescem quando aderidas a uma superfície. Nesse processo, são usados os beads, micropartículas esféricas que podem ser feitas de substâncias como alginato, quitosana e colágeno. O uso de alginato tem sido preferido, por se tratar de um polímero natural e comestível, livre de derivados animais e de baixo custo.
Nessa etapa de proliferação celular, ocorre um aumento da massa. De acordo com o processo desenvolvido pelo pesquisador holandês Mark Post, a partir de uma pequena amostra do tecido muscular da vaca, é possível produzir 800 milhões de fios de tecido muscular, o equivalente a aproximadamente 9 quilos de carne.
Quando as células satélites aderidas às micropartículas atingem uma quantidade considerada suficiente, o meio de cultura é alterado para induzir a diferenciação celular. As células se diferenciam formando miotubos, que são fibras musculares primitivas. A última etapa consiste na maturação desses miotubos, por meio da aplicação de um estímulo mecânico que desencadeia o crescimento e a organização das fibras musculares em unidades contráteis.
Essas fibras musculares maduras são colhidas e misturadas com outros ingredientes para a obtenção do produto final, uma carne não estruturada, como hambúrgueres, almôndegas, nuggets, entre outros (Figura 2). Todo esse processo pode durar de 2 a 6 semanas. A primeira carne desenvolvida em laboratório a chegar aos supermercados será desse tipo.
A produção de um bife de boi ou de frango segue um processo mais complexo e apresenta um desafio técnico superior, já que a carne é formada por fibras musculares, células de gordura, vasos sanguíneos e tecido conjuntivo. Uma das propostas existentes é que o processo se inicie da mesma forma que a cultura em suspensão, com o uso de beads para a etapa de proliferação celular. Em seguida, para produzir esse tipo de carne estruturada, uma grande quantidade de células passa pelo processo de diferenciação e maturação em uma estrutura tridimensional, o scaffold, que sustenta e direciona o desenvolvimento do tecido para formar diversos tipos celulares (células satélites, adipócitos, fibroblastos).
O scaffold pode ser definido como um biomaterial que mimetiza a estrutura da matriz extracelular presente nos tecidos animais. Ele deve ser comestível ou biodegradável, espesso, poroso e capaz de suportar e dar formato ao novo tecido formado. Durante o desenvolvimento desse tecido estruturado, os scaffolds devem conduzir à formação de um sistema semelhante a um vaso sanguíneo, para permitir a circulação de nutrientes e oxigênio por todo o tecido e evitar a morte das células no interior da estrutura.
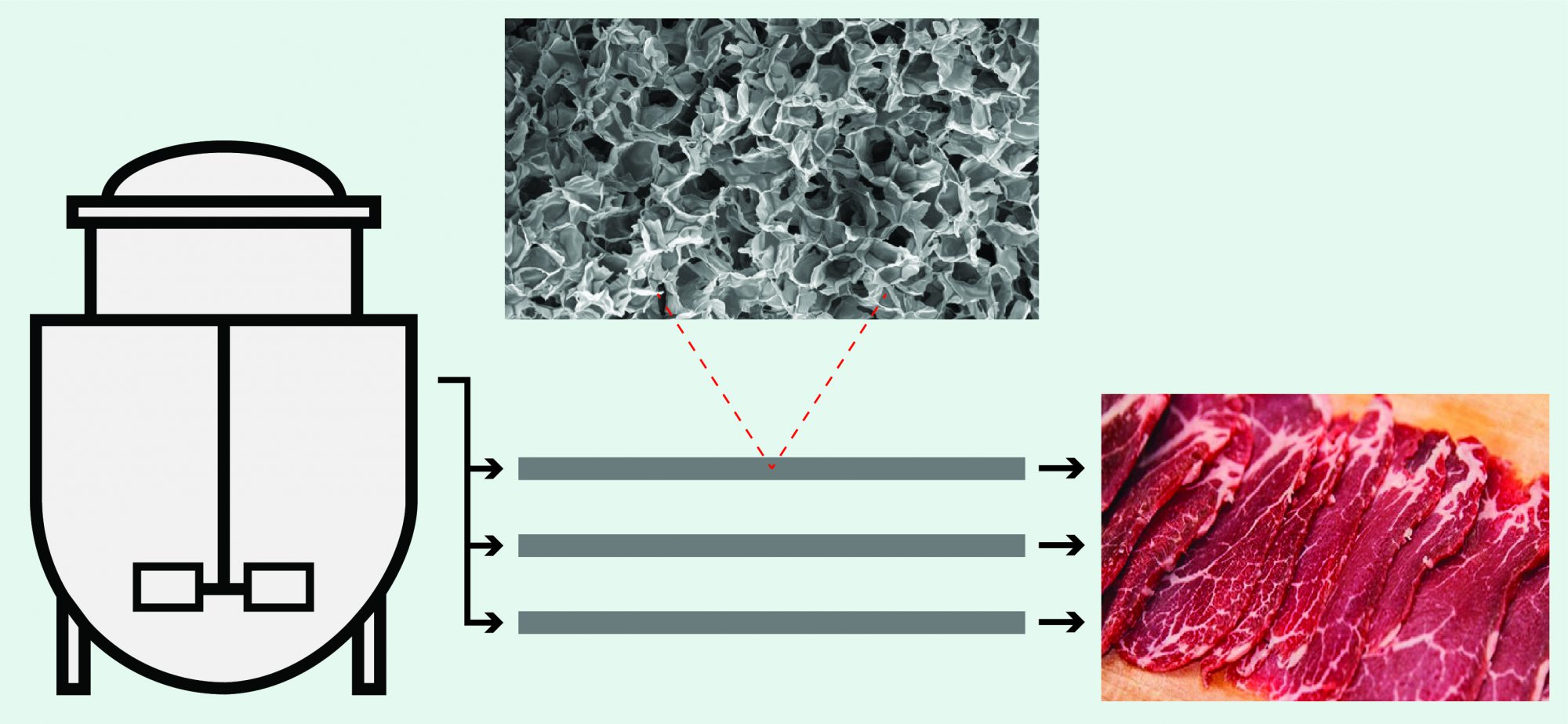
E por que não produzir carne estruturada a partir da metodologia já adotada na produção de tecidos humanos 3D, como pele, cartilagem e ossos? É que a indústria de carne cultivada tem algumas particularidades. O processo precisa ser realizado em uma escala maior de produção, além de ser sustentável e livre de derivados animais. As opções de scaffolds, biorreatores e até as metodologias de cultura 3D disponíveis foram projetadas para fins biomédicos e não para produção de carne limpa em elevada quantidade, representando, assim, alguns dos desafios para o sucesso do produto.
Esses não são os únicos desafios técnicos que precisam ser superados para levar a carne de laboratório ao mercado. A escalabilidade e viabilidade econômica do processo dependem da superação de uma série de obstáculos. A definição do tipo de célula mais adequada para um processo produtivo eficiente é um deles. As células consideradas ideais são aquelas cuja capacidade de proliferação e diferenciação seja alta e não dependa de produtos de origem animal.
O meio de cultura é outro desafio – e talvez um dos mais difíceis de superar –, pois deve ser livre de produtos de origem animal, ter uma composição definida, conter as moléculas sinalizadoras e ser economicamente viável em larga escala. Atualmente, o soro bovino fetal (SBF), coletado dos fetos de vacas grávidas abatidas, é o mais utilizado para cultivar células de mamíferos. Esse produto, além de não seguir a proposta da carne limpa, é muito caro. Algumas empresas, como Memphis Meat e Just, afirmam ter desenvolvido alternativas ao SBF, porém a composição dessas formulações ainda é segredo.
O desenvolvimento de biorreatores otimizados, capazes de melhorar a eficiência do uso do meio de cultura, reciclar os principais componentes desse meio e fornecer as condições necessárias para estimular a diferenciação celular é outro grande desafio. O cultivo de carne, principalmente a estruturada, poderá exigir mais de um biorreator, sendo um para a proliferação e outro para a diferenciação celular. Diversos biorreatores, desenvolvidos para a indústria de biotecnologia, farmacêutica e biomédica, estão disponíveis no mercado, mas precisam ser adaptados para a escala demandada pela indústria de alimentos.
Os esforços para baixar o custo da tecnologia e usá-la em maior escala estão sendo feitos por alguns grupos de pesquisa, mas principalmente por empresas, inclusive no Vale do Silício, nos Estados Unidos. Em 2015, foi fundada a Memphis Meat, primeira empresa de base tecnológica com foco na produção de carne cultivada em laboratório. Um ano depois, produziu sua primeira almôndega a um custo de US$ 2.400 o quilo. Foi uma redução de 100 vezes em relação ao primeiro hambúrguer produzido. O custo mais recente, publicado pela empresa israelita Aleph Farms, é US$ 221 por quilo de carne. A empresa Just prevê levar sua carne ao mercado a partir de 2021.

No Brasil, estão atuando no setor alguns grupos de pesquisa e uma empresa derivada de um deles, a Biomimetic Solutions, que trabalha com o Grupo de Pesquisas em Biomateriais do Departamento de Engenharia de Materiais do Cefet-MG no desenvolvimento de scaffolds para produzir carne estruturada (Figura 4). Em parceria com o Laboratório de Biologia Oral e do Desenvolvimento do Departamento de Morfologia do Instituto de Ciências Biológicas da Universidade Federal de Minas Gerais, também desenvolvem peito de frango, com técnicas de cultura celular 3D.
Se for bem-sucedida em superar os desafios técnicos e obter aceitação em massa, a carne cultivada será uma poderosa ferramenta para criar um sistema alimentar mais saudável, mais eficiente e mais humano.
Roberta Viana Ferreira e Ana Elisa Antunes dos Santos
Departamento de Engenharia de Materiais,
Centro Federal de Educação Tecnológica (Cefet-MG)

Criado há mais de 20 anos diante do aumento das queimadas, o sistema brasileiro de monitoramento por satélites é um dos mais acurados do mundo, capaz de informar, em tempo real, o corte de vegetação e analisar o uso da terra. Desafio é usar informações para preservar a biodiversidade.

Certamente, você já ouviu falar do silicone usado em cirurgias plásticas. Mas sabia que seu principal componente é o silício? E que esse elemento químico está em alimentos, cosméticos, medicamentos, circuitos eletrônicos e painéis solares?

Diferentes dos seres assustadores e perigosos da ficção, as plantas carnívoras podem trazer inúmeros benefícios aos humanos. As orvalhinhas, por exemplo, muito frequentes no Brasil, são capazes de combater diversas doenças, como o câncer, mas sofrem ameaça de extinção.

Desde a Antiguidade, a humanidade vem acumulando conhecimento preciso e confiável sobre os fenômenos elétricos e magnéticos. Mas hoje, infelizmente, há oportunistas que, com base em ideias pseudocientíficas, vendem produtos que prometem curas ou tratamentos milagrosos.

O surgimento da vida é um tema que desperta o interesse da humanidade há milênios e até hoje continua cercado de mistérios. Em uma série de colunas, Alexander Kellner apresenta várias abordagens dessa questão, começando com as explicações dadas por diferentes culturas e religiões.
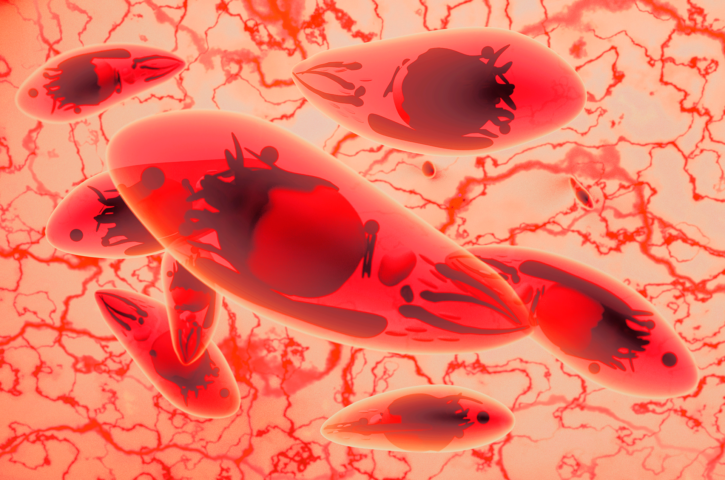
Doença causada pelo parasita Toxoplasma gondii atinge milhões de brasileiros, com consequências graves para a saúde pública. Pesquisadores estão propondo alternativas de tratamento para acelerar o processo de descoberta de novos medicamentos e assim beneficiar os pacientes.

A exploração do espaço voltou a ganhar momento, com a entrada em cena não só de novas agências espaciais, mas também de empresas que exploram comercialmente essa atividade. A tensão ideológica que marcou esse campo foi substituída pela cooperação

O mercado de sementes modificadas e dependentes de pesticidas tóxicos à saúde e ao ambiente está cada vez mais concentrado em algumas poucas megaempresas. É essencial visibilizar as formas de produção por trás do que comemos para alcançar alternativas saudáveis e justas

Há 50 anos, o lançamento do satélite Landsat-1 transformou nosso olhar sobre a superfície terrestre. Hoje, as técnicas de machine learning e deep learning promovem uma nova revolução, desta vez na “visão” dos computadores e no sensoriamento remoto do planeta

A física quântica, que lida com o microuniverso atômico e subatômico, promete revolucionar as comunicações. Pergunta procedente neste Ano Internacional da Ciência e das Tecnologias Quânticas: o Brasil será um agente ativo nessa nova era tecnológica?

Este é o Ano Internacional da Ciência e das Tecnologias Quânticas. Poder soar como tema para poucos. Mas os fenômenos quânticos e suas aplicações permeiam nosso cotidiano, trazendo bem-estar à sociedade. Mais: nos ensinam o valor da pesquisa em ciência básica.

Nascido na forma de um experimento mental, o emaranhamento quântico levou décadas até ser comprovado. Hoje, ao comemorarmos o Ano Internacional da Ciência e das Tecnologias Quânticas, esse fenômeno define a essência da física quântica

Os fenômenos do mundo macroscópico, em que vivemos, são bem diferentes daqueles que ocorrem com átomos e moléculas. Há uma sutil (e misteriosa) fronteira entre esses dois mundos, apresentada neste artigo, que comemora o Ano Internacional da Ciência e das Tecnologias Quânticas

Imagine o mundo atual sem o bronze, o latão ou o aço. Quase impossível. As ligas metálicas fazem parte da humanidade desde a Antiguidade. Hoje, o desenvolvimento dessas misturas de elementos químicos conta com ajuda importante: computação avançada e inteligência artificial

Em 1925, o físico Albert Einstein, um dos maiores cientistas de todos os tempos, desembarcava no porto do Rio de Janeiro. A viagem – que incluiu Argentina e Uruguai – deixou um legado importante: evidenciou a importância da pesquisa básica no meio acadêmico brasileiro
| Cookie | Duração | Descrição |
|---|---|---|
| cookielawinfo-checkbox-analytics | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookie is used to store the user consent for the cookies in the category "Analytics". |
| cookielawinfo-checkbox-functional | 11 months | The cookie is set by GDPR cookie consent to record the user consent for the cookies in the category "Functional". |
| cookielawinfo-checkbox-necessary | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookies is used to store the user consent for the cookies in the category "Necessary". |
| cookielawinfo-checkbox-others | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookie is used to store the user consent for the cookies in the category "Other. |
| cookielawinfo-checkbox-performance | 11 months | This cookie is set by GDPR Cookie Consent plugin. The cookie is used to store the user consent for the cookies in the category "Performance". |
| viewed_cookie_policy | 11 months | The cookie is set by the GDPR Cookie Consent plugin and is used to store whether or not user has consented to the use of cookies. It does not store any personal data. |
